
Actualidad Cientifica
Revista 633
Revelan cómo funcionan las células mieloides en el cáncer

Gabriel Rabinovich (director del estudio), Ada Blidner (primera autora del trabajo) e investigadores y becarios del Instituto del IBYME. Créditos: CONICET Fotografía / Verónica Tello.
Este nuevo conocimiento vincula las funciones conocidas de Galectina 1 con las dos grandes funciones de las células mieloides supresoras (MDSCs) –la inmunosupresión y la angiogénesis– en entornos tumorales y propone una futura terapia contra el cáncer mediante el bloqueo de Gal-1, utilizando anticuerpos monoclonales.
Por Ana M. Pertierra
Las células mieloides son fundamentales para la protección del huésped. Evolucionaron como una barrera crítica contra las infecciones y contribuyen de forma importante a la remodelación tisular. Sin embargo, en el cáncer, las células mieloides se transforman en gran medida para servir a un nuevo receptor: las células tumorales. Se trata de las llamadas células mieloides supresoras (MDSCs), que nacen en la médula ósea (al igual que muchas células del sistema inmune), pero en lugar de combatir el cáncer, promueven su crecimiento, diseminación y progresión. Estas células, que están estrechamente relacionadas con los neutrófilos y los monocitos, no se encuentran en estado estacionario en individuos sanos y aparecen en el cáncer y en afecciones patológicas asociadas con la inflamación crónica o el estrés. En los últimos años, una gran evidencia respalda el papel clave de las MDSC en la inmunosupresión en el cáncer, así como su papel destacado en la angiogénesis tumoral, la farmacorresistencia y la promoción de metástasis tumorales.
En este estudio, que se publica en Immunity (https://doi.org/10.1016/j.immuni.2025.04.027), científicos del CONICET, liderados por el Dr. Gabriel Rabinovich, investigador en el Laboratorio de Glicomedicina del Instituto de Biología y Medicina Experimental (IBYME, CONICET-Fundación IBYME), y que tiene como autora protagónica a la investigadora del CONICET Ada Blidner (del mismo laboratorio), lograron demostrar que, al acercarse a ambientes tumorales, las MDSCs alteran la composición de los azúcares (glicanos) que rodean su superficie, volviéndose más atractivas para la unión de la proteína Galectina-1 (GAL-1). Cuando GAL-1 se une a los glicanos en las MDSCs, decodifica la información presente en su estructura y las reprograma (a las células) para que, -de manera simultánea- supriman a los linfocitos T responsables de destruir al tumor y ordenen a las células endoteliales que formen nuevos vasos sanguíneos.

Gabriel Rabinovich (director del estudio) y Ada Blidner (primera autora del trabajo). Créditos: CONICET Fotografía / Verónica Tello
FABAinforma se comunicó con la Dra. Ada Blidner, primera autora del trabajo, quien explicó los alcances de estos nuevos hallazgos y sus posibles aplicaciones en la terapia contra el cáncer de colon.
¿Cuál es el nuevo conocimiento que ustedes aportan en este trabajo recientemente publicado en la revista Immunity?
Los que nos dedicamos y amamos la ciencia sabemos que los grandes paradigmas se concretan a través de la construcción consecutiva de nuevo conocimiento. En este sentido, este trabajo brinda nuevas evidencias que logran vincular las funciones conocidas de Gal1 con las dos grandes funciones de las células mieloides supresoras (MDSCs), las células más misteriosas en cáncer. Dado que las MDSCs son un componente celular implicado en la resistencia a numerosas terapias antitumorales (quimioterapia, radioterapia, terapias Target , terapias antiangiogénicas e inmunoterapias), eso implica tres grandes beneficios:
- identificar un sistema en el microambiente tumoral, basado en la interacción de galectinas y glicanos como orquestadores de las dos grandes acciones pro tumorales de las MDSCs y
- como corolario, al conocer la molécula maestra detrás de las funciones pro tumorales de estas células, esto nos permite proponer una posible terapia de bloqueo de Gal1, la cual sería capaz de reprogramar a las MDSCs hacia un fenotipo antitumoral las cuales disminuyen simultáneamente sus funciones inmunosupresoras y pro- angiogenicas.
- Dado que encontramos una correlación entre la expresión de Gal1, la acumulación y actividad pro tumoral de las MDSCs y el mal pronóstico en pacientes con una gran variedad de tipos de cáncer y la resistencia a la inmunoterapia en pacientes con cáncer de colon y melanoma, podríamos estar estableciendo un nuevo biomarcador constituido por una combinación de la expresión de Gal1 y el score de MDSCs generado por nosotros en este trabajo.
¿Qué significa reprogramar las células MDSC?
Las células mieloides supresoras son por naturaleza una población heterogénea y muy "plástica" es decir que dependiendo el microambiente en el que se encuentren pueden cambiar su actividad hacia un fenotipo más inflamatorio o hacia un fenotipo inmunosupresor o de reparación de heridas (lo cual también incluye promover la neovascularización). Normalmente en cáncer, estas células llegan al tejido tumoral y adoptan funciones inmunosupresoras y pro-angiogénicas, que nosotros encontramos en este trabajo se ven acompañadas de una firma de glicanos particular al microambiente tumoral, sensible a la unión de Gal1. La palabra "reprogramar" se refiere a que a través de la terapia con el anticuerpo monoclonal anti-Gal1, o a través de la ablación de los ligandos específicos de Gal1, pudimos revertir este fenotipo pro-tumoral de las MDSCs, polarizándolas hacia una actividad más pro-inflamatoria que lograba estimular mejor a linfocitos T CD8, tan importantes en la respuesta inmune anti-tumoral.
¿Qué tecnologías emplearon en el estudio y sobre qué muestras trabajaron?
Utilizamos estrategias in vitro, cultivos 3D, citometría de flujo, proteómica, glicoanalítica (UPLC-HILIC-FLR, WAX-HPLC-FLR), inmunofluorescencia múltiple, estudios bioinformáticos y estrategias in vivo con animales transgénicos y modelos experimentales de cáncer colon. Los modelos in vitro e in vivo fueron realizados con células y muestras de ratones. Los estudios bioinformáticos fueron hechos a través del análisis de repositorios de datos de pacientes con tumores (TCGA) y tratados con inmunoterapia (papers previamente publicados por otros grupos). La inmunofluorescencia multiplex fue realizada utilizando arrays de tejidos de adenocarcinoma de colon, acompañados de sus controles de tejidos sanos, de pacientes con tumores en distintos estados de progresión tumoral.
¿De qué modo este nuevo conocimiento puede ser útil para implementar nuevos tratamientos contra el cáncer?
Gracias a este trabajo podemos proponer una futura terapia de bloqueo de Galectina-1, utilizando un anticuerpo monoclonal diseñado en el laboratorio, que pueda simultáneamente inhibir la inmunosupresión y la angiogénesis mediadas por el tumor, en parte, a través de la activación de las MDSCs. En segundo lugar, la expresión de Galectina-1 combinada con la firma de MDSCs activadas, podría ser un biomarcador de progresión tumoral y de predicción de resistencia a distintas terapias oncológicas.
¿Qué rol tendría el uso de anticuerpos anti GAL-1 en el tratamiento de cáncer de colon? ¿En qué etapa de desarrollo se encuentran?
Creemos que este anticuerpo anti-GAL1 podría ser utilizado en pacientes con cáncer de colon que posean tumores con alta expresión de GAL1, los cuales podrían tratarse en primera línea solo o en combinación con otras terapias, o en líneas consecutivas luego de una recaída a los tratamientos disponibles (inmunoterapias, terapias anti-angiogénicas, quimioterapia, etc). Todas estas son suposiciones basadas en nuestros hallazgos que podremos dilucidar sólo luego de los ensayos clínicos pertinentes. Actualmente nos encontramos en la fase de pruebas pre-clínicas, es decir estudiar el anticuerpo en modelos experimentales. Asimismo, a través de nuestra empresa de base biotecnológica, Galtec, comenzamos la humanización y optimización del anticuerpo con el fin de conseguir la molécula más eficaz que podrá ser utilizada en los futuros ensayos clínicos en pacientes.
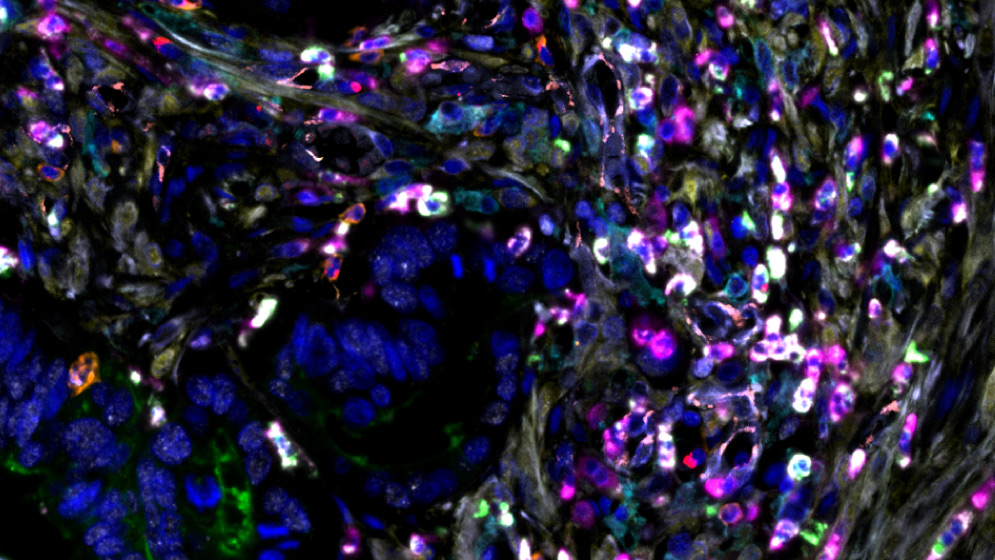
Tejido tumoral de cáncer de colon. Se puede observar una expresión elevada de GAL-1, acompañada de una acumulación de MDSCs y baja presencia de linfocitos.
Queremos agradecer a todas las Instituciones y Fundaciones que nos han acompañado a lo largo de los años, sin las cuales este trabajo de investigación no hubiera sido posible: Programa de Redes Federales de Alto Impacto del ex Ministerio de Ciencia, Tecnología e Innovación, la Agencia Nacional de Promoción Científica y Tecnológica, y Fundaciones como Sales, Barón, Bunge & Born, Williams, junto con donantes particulares como las familias Ferioli, Ostry, Caraballo y Alfonzo.
